definicija periodičnog zakona
 The periodični zakon je li on temelj periodnog sustava elemenata, kao univerzalna shema koja organizira, klasificira i distribuira različite postojeće kemijske elemente u odnosu na njihove karakteristike i svojstva.
The periodični zakon je li on temelj periodnog sustava elemenata, kao univerzalna shema koja organizira, klasificira i distribuira različite postojeće kemijske elemente u odnosu na njihove karakteristike i svojstva.
Baza na kojoj se nalazi periodni sustav elemenata
U međuvremenu, periodični zakon predviđa da su fizička i kemijska svojstva gore spomenutih elemenata skloni su sustavnom ponavljanju kako se atomski broj elemenata povećava.
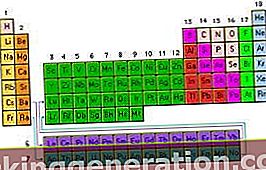
Periodni sustav: organizacija kemijskih elemenata u porastu prema broju atoma koji svaki od njih ima
Tako poznata tablica elemenata koje proučavamo u školi, iz predmeta fizike i kemije, shema je koja se bavi uređivanjem kemijskih elemenata prema njihovom sve većem redoslijedu u smislu broja atoma.
Okomiti stupci tablice nazivaju se skupinama i sadrže elemente s istom atomskom valencijom i stoga imaju slična svojstva, dok vodoravni redovi, nazvani točkama, grupiraju elemente različitih svojstava, ali imaju slične mase.
Kako je napredovalo ovo znanje: specifični i postupni događaji
Treba napomenuti da su se svi ti pojmovi svojstveni fizici i kemiji razvijali postupno i postupno tijekom devetnaestog stoljeća.
Moramo reći da su neki elementi poput srebra (Ag), zlata (Au), bakra (Cu), olova (Pb) i žive (Hg) već od davnina imali savršeno znanje, dogodilo se prvo znanstveno otkriće elementa tijekom sedamnaestog stoljeća, kada je alkemičar Henning Brand prvi put identificirao element fosfor (P).
U sljedećem stoljeću, odnosno u 18. stoljeću, počeli su se poznavati novi elementi, a najrelevantniji su plinovi, zahvaljujući razvoju pneumatske kemije, uključujući kisik (O), dušik (N) i vodik (H).
Otprilike u to vrijeme francuski kemičar Antoine Lavoisier napisao je popis jednostavnih tvari u kojima su se već pojavila 33 elementa.
Početkom devetnaestog stoljeća izum električne baterije pokrenuo je proučavanje novih kemijskih pojava i to je na kraju generiralo otkriće više elemenata, poput alkalnih i zemnoalkalijskih metala.
Do 1830. već je identificirano 55 elemenata.
Sredinom devetnaestog stoljeća, izumom uređaja nazvanog spektroskop, pronađeno je više elemenata, posebno onih povezanih s bojom koji su predstavljali njihove spektralne linije, uključujući cezij, talij i rubidij.
Spektroskop je instrument koji se koristi za promatranje i postizanje spektra, budući da je to rezultat raspršivanja niza pojava zračenja, zvuka ili valova.
Sličnost koju su pojedini elementi predstavljali u smislu kemijskih i fizičkih svojstava navela je neke znanstvenike toga doba da ih odluče sustavno poredati, grupirati prema određenim kriterijima.
Najudaljeniji prethodnik zakona koji je u pitanju imamo poznati Zakon o oktavama, razvio ga je engleski kemičar John Alexander Newlands, koji je predložio buđenje velike novosti, da se svakih osam elemenata suočimo sa sličnim svojstvima.
To mu je bilo početno vrijeme za formuliranje vlastitog periodnog sustava službeno objavljenog 1863. godine.
Kao da je netko bio u post utrci, rukavicu je u tom smislu uzeo drugi kemičar, u ovom slučaju Nijemac Julius Lothar Meyer, koji je koristeći polazište rezultate Newlandsa, 1870. godine, odredio atomske zapremine elemenata.
Jednom kada je izračunao atomske težine i predstavio ih, bio je u stanju pokazati svijetu znanosti potvrdu da atomska težina podrazumijeva povećanje fizičkih svojstava.
I gotovo istodobno s Meyerovim djelima, Kemičar ruskog porijekla Dimitri Mendeleev objavljuje prvi periodni sustav, pobijedivši Meyera koji bi to učinio godinu dana kasnije i stoga je on taj koji je ostao zaslužan da bude njegov tvorac.
Mendeljejev bi elemente poredali u sve većem redoslijedu na temelju atomske mase koju predstavljajuU međuvremenu je one koji su dijelili neke karakteristike smjestio u istu kolonu.
Vrijedno je spomenuti da su u to vrijeme već bila poznata 63 elementa od 90 postojećih.
Stol je dovršen krajem 19. stoljeća s drugom skupinom, koja se zvala nula, i sastojala se od plemenitih plinova.